§7. Белки. Состав и строение белков
Подробное решение параграф §7 по биологии для учащихся 10 класса, авторов Теремов А.В., Петросова Р.А. Углубленный уровень 2017
Ст. 41
Рассмотрите приведенные в табл.3 структурные формулы аминокислот. Какие химические элементы входят в состав этих аминокислот?
Кислород, водород, углерод, азот.
Ст. 49
Вопросы и задания
1. В чём сходство и отличия в строении аминокислот? Чем определяется уникальность свойств каждой аминокислоты?
Аминокислоты имеют двойственную природу. Наличие карбоксильной группы определяет их кислотные свойства, а аминогруппы – основные. Большинство аминокислот – амфотерные вещества. Аминокислоты отличаются друг от друга строением радикалов. Последние могут содержать дополнительную карбоксильную группу или аминогруппу, а также атомы серы, способные образовывать между собой дисульфидные связи, включать гидрофильные или гидрофобные группировки атомов.
Все аминокислоты состоит из амино — группы и карбонильной группы, но отличаются радикалом. Каждая аминокислота имеет свой радикал, чем они и отличаются.
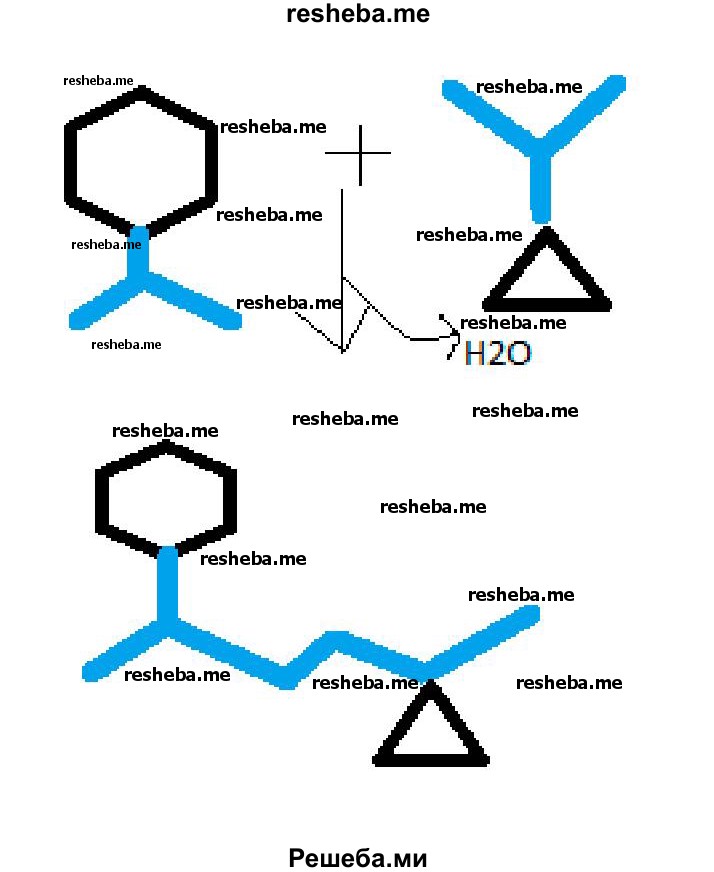
2. За счёт взаимодействия каких групп аминокислот происходит образование пептидных связей? Нарисуйте схему пептидной связи.
Связь, образованная между карбоксильной группой одной аминокислоты и аминогруппой другой, называется пептидной связью.
3. Какие связи стабилизируют вторичную структуру белковой молекулы? Почему вторичная структура пептидов достаточно прочная, хотя поддерживающие её связи значительно слабее ковалентных?
Вторичная структура белка – это определённая компоновка полипептидной цепи за счёт водородных связей, возникающих между СО — и NH — группами. Существуют два типа вторичной структуры: α — спираль и (3 — структура (рис. 31).
а — спираль – полипептидная цепь, закрученная спирально и удерживаемая водородными связями, возникающими между группами –СО– и –NH– в витках спирали.
Другой разновидностью вторичной структуры является β — структура. Это слоистая, складчатая структура, образованная параллельно расположен — ными соседними участками полипептидных цепей. Слои в этой структуре также связаны друг с другом водородными связями. (3 — структура встречается в глобулярных белках, где чередуется с а — спиральными участками.
Хотя водородные связи слабее ковалентных, присутствие их в значительном количестве делает структуры типа a — спирали или b — складчатого слоя достаточно прочными.
4. Используя формулы из табл. 3, напишите в тетради структурную формулу трипептида аланил — цистеинил — глицина.
NH2 — CH(CH3) — CO — NH — CH(CH2SH) — CO — NH — CH2 — COOH
5. Что представляет собой третичная структура белковой молекулы? Назовите типы химических связей, стабилизирующих третичную структуру (см. рис. 32). Какие из них наиболее прочные? Объясните почему.
Третичная структура – это пространственная конфигурация белка в виде компактных глобул.
Связи, стабилизирующие третичную структуру белка. В стабилизации третичной структуры играют роль связи между боковыми радикалами аминокислот.
С О H N Водородная связь между аминокислотами.
S S Дисульфидная связь между серусодержащими радикалами цистеина
COO – H3N+ Ионная связь между заряженными группами полипептидной цепи.
R R Гидрофобная связь между неполярными радикалами аминокислот.
Пептидная связь – Сама пептидная связь является частично двойной в силу лактим — лактамной таутомерии. Поэтому вокруг нее невозможно вращение, а сама она по прочности в полтора раза превосходит обычную ковалентную связь.
6. Имеются три вида аминокислот – А, В, С. Составьте несколько вариантов пептидов из пяти аминокислот. Будут ли эти пентапептиды обладать одинаковыми свойствами и структурами? Ответ поясните.
АВСАВ
АВССВ
СААВВ
СВАВА
САСАВ
ВАВСА
Эти пять вариантов пептидов будут обладать различными свойствами и функциями. Так как в белках основополагающую роль играет, не просто набор аминокислот, но и их последовательность.