§ 6. Молекулярный уровень: общая характеристика
Подробное решение параграф § 6 по биологии для учащихся 10 класса, авторов Пасечник В.В., Каменский А.А., Рубцов А.М. Углубленный уровень 2019
Вопрос 1. Каковы основные положения атомно — молекулярного учения?
1) Все вещества состоят из молекул.
2) Молекулы состоят из атомов. Атомы каждого вида (элемента) одинаковы между собой, но отличаются от атомов любого другого вида.
3) Частицы — молекулы и атомы — находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц.
4) При взаимодействии атомов образуются молекулы: гомоядерные — при соединении атомов одного вида (например, H2, O2), образующиеся при этом вещества называются простыми; гетероядерные — при взаимодействии атомов разного вида (например, H2O, H2SO4), образующиеся при этом вещества называются сложными.
5) При физических явлениях молекулы сохраняются, при химических — разрушаются (или образуются новые). Атомы же и при физических, и при химических реакциях остаются неизменными.
6) Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состоят первоначальные вещества.
Вопрос 2. Что такое химические элементы? Как устроены атомы разных химических элементов?
Химический элемент — совокупность атомных частиц (электронейтральных атомов и одноатомных ионов) с одинаково положительным зарядом ядра.
Атомы чрезвычайно малы, их диаметр колеблется в пределах 0,2 — 0,5 нм (1 нм = 10 — 9 м). Массы атомов составляют порядка 10 — 24 — 10 — 22 г. Атомы имеют сложное строение и состоят из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов.
Вопрос 3. Что такое валентные электроны?
Валентные электроны — это такие электроны, которые участвуют в образовании химических связей.
Вопрос 4. Чем различаются свойства химических элементов главных и побочных подгрупп из левой и правой частей таблицы Менделеева?
Главное отличие в особенности заполнения электронами орбиталей и, соответственно, различие химических свойств.
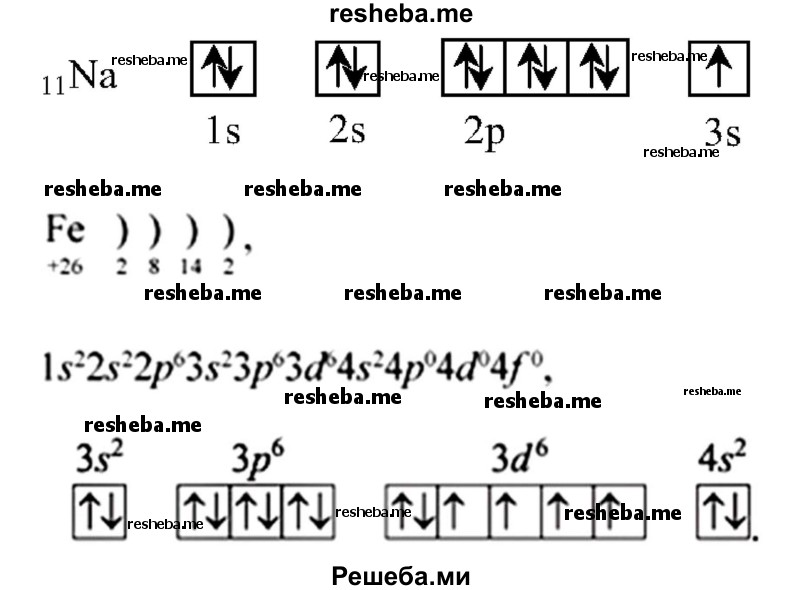
Химические свойства, например, у s — элементов 1 группы — валентность 1, степень окисления — +1. А у d — элементов — переменная валентность и степень окисления, т.к у них есть свободные орбитали для заполнения электронами. К примеру, представлены электронно — графические схемы Na и Fe.
Вопрос 5. Какие химические элементы относят к группе макроэлементов и почему?
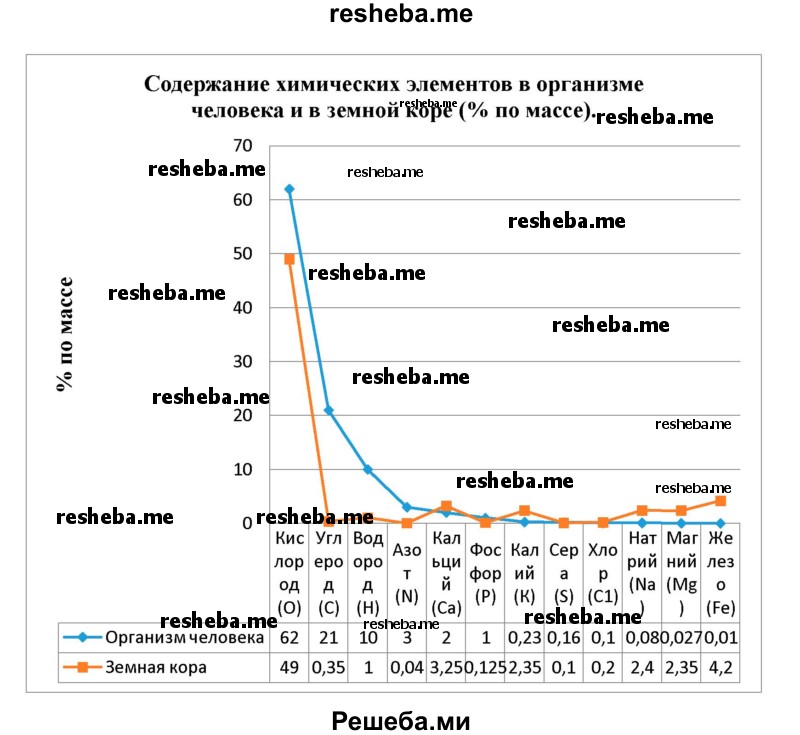
К группе макроэлементов относят химические элементы, содержание которых в живых организмах превышает 0,01 %. В значительных количествах встречаются 4 хим. элемента (кислород, углерод, водород и азот) (в сумме около 96 %) и ещё 8: кальций, фосфор, калий, сера, хлор, натрий, магний и железо.
Вопрос 6. Из чего состоят молекулы различных веществ? Что лежит в основе образования их структуры?
Молекулы состоят из атомов различных химических элементов. в основе образования их структуры обеспечивается возникновением химической связи между входящими в их состав атомами. Эти связи возникают вследствие объединения электронных оболочек атомов, которые образуют молекулу.
Вопрос 7. Что лежит в основе разделения веществ на органические и неорганические?
В основе разделения веществ на органические и неорганические лежит происхождение и наличие углерода в составе этих веществ (СО, СО2, Н2СО3 и карбонаты — это неорганические вещества).
Вопрос 8. Какие особенности атомов углерода обусловливают многообразие органических веществ в природе?
Очень важной особенностью атома углерода является его способность образовывать связи сразу с четырьмя другими такими же атомами. Благодаря этой способности атомы углерода могут образовывать каркасы огромного количества разнообразных биологических молекул, что способствует появлению многообразных органических веществ в природе.
Вопрос 9. Какие органические вещества являются биополимерами? Приведите примеры известных вам регулярных и нерегулярных полимеров, гомо — и гетерополимеров.
Биополимеры — высокомолекулярные органические соединения, входящие в состав живых организмов (белки, полисахариды, нуклеиновые кислоты).
Пример регулярных полимеров: крахмал, полисахариды, целлюлоза, гликоген.
Пример нерегулярных полимеров: белки, нуклеиновые кислоты.
Пример гомополимеров: крахмал, полисахариды, целлюлоза, гликоген.
Пример гетерополимеров: белки, нуклеиновые кислоты.
Вопрос 10. Используя данные таблицы 1, постройте диаграмму, отражающую содержание указанных в ней химических элементов в организме человека и в земной коре (% по массе).
Вопрос 11. Прочитайте статью «Химические связи в молекулах веществ». Составьте схему образования молекул известных вам веществ: водорода (Н2), кислорода (02), воды (Н20), хлорида натрия (NaCl) и метана (СН4). Подпишите на схеме названия типов химических связей, участвующих в образовании этих веществ.

В молекуле воды между атомами водорода и кислорода — ковалентная полярная связь. А водородная связь возникает МЕЖДУ МОЛЕКУЛАМИ ВОДЫ (а не В МОЛЕКУЛЕ воды).
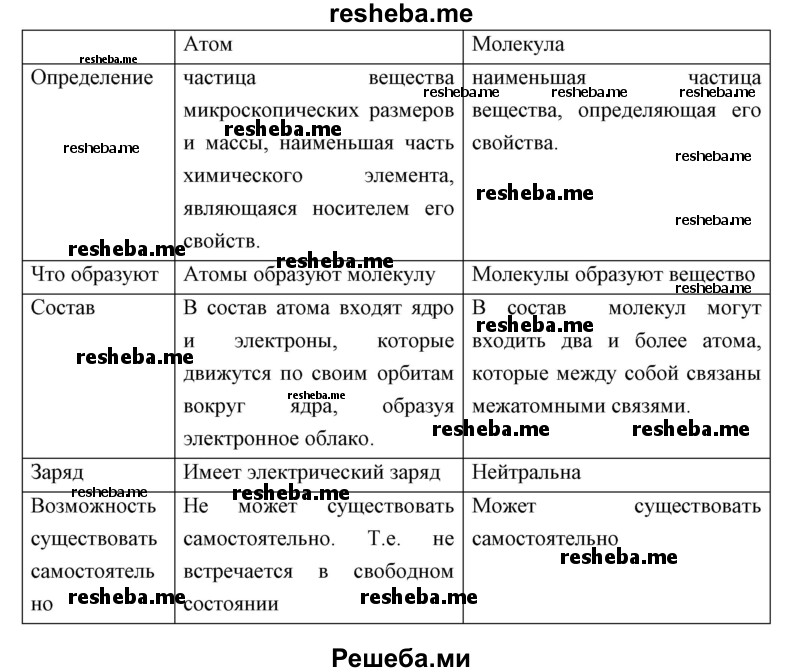
Вопрос 12. Используя материалы Википедии (https://ru.wikipedia.org), обобщите собственные представления о строении атома и молекул. Оформите их в виде таблицы.
Вопрос 13. Используя доступные информационные источники, найдите и рассмотрите периодическую таблицу химических элементов Д. И. Менделеева. Найдите в ней элементы, относящиеся к микро — и макроэлементам. Атомы нескольких химических элементов обладают строением, сходным со строением атомов углерода. Назовите эти элементы. Могли бы они заменить углерод в структуре органических веществ? Ответ обоснуйте и подкрепите известными вам примерами.
К макроэлементам относятся 12 химических элементов: кислород, углерод, водород и азот, кальций, фосфор, калий, сера, хлор, натрий, магний и железо. Всего в живых организмах найдено более 80 химических элементов, однако содержание большинства из них крайне мало — это микроэлементы (медь, йод, цинк, кобальт, кремний, марганец, литий и др.).
Макроэлементы обозначены красным, а микроэлементы — синим.
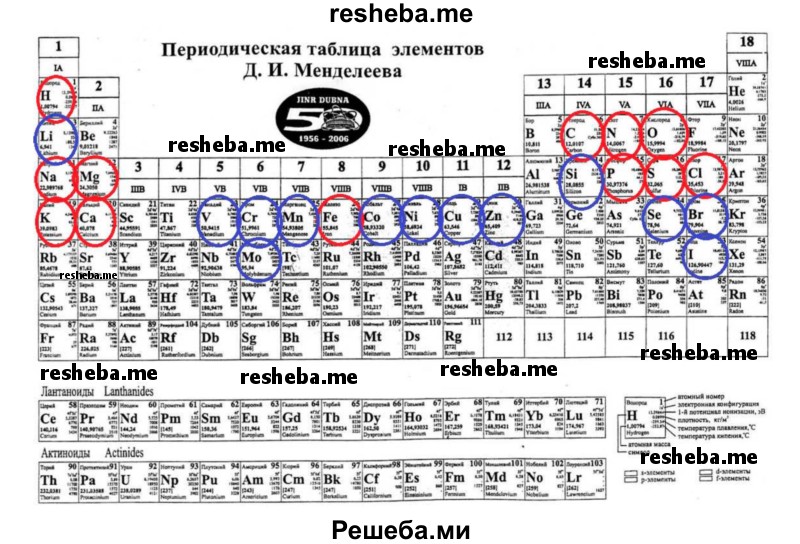
Кремний, бор и азот обладают строением, сходным со строением атомов углерода. Но они не могут заменить углерод в структуре органических веществ, потому что:
1. Заполненный внешний электрический слой.
2. Обладает низкой окислительной способностью.
3. Строение атома элемента углерода включает две оболочки, на которых расположено шесть электронов. Валентность углерода, входящего в состав органических веществ, постоянна и равна IV. Это значит, что на внешнем электронном уровне находится четыре электрона, а на внутреннем — два.
4. Возбуждённый атом углерода имеет четыре неспаренных электрона. Его конфигурацию можно выразить формулой 2s12p3. Это даёт возможность образовывать четыре ковалентные связи с другими элементами.
5. Полимерные молекулы способны образовывать в большей степени углерод, сера, фосфор, селен и теллур, а в меньшей — кремний, германий, бор, мышьяк (As), олово (Sn) и сурьма (Sb). Способность образовывать достаточно прочные гомоцепные полимеры зависит от прочности связей атомов данного элемента друг с другом (у углерода этот показатель самый высокий — 80 ккал/моль, смотрите табл.)
Табл. Энергия некоторых связей в гомоцепных полимерах.
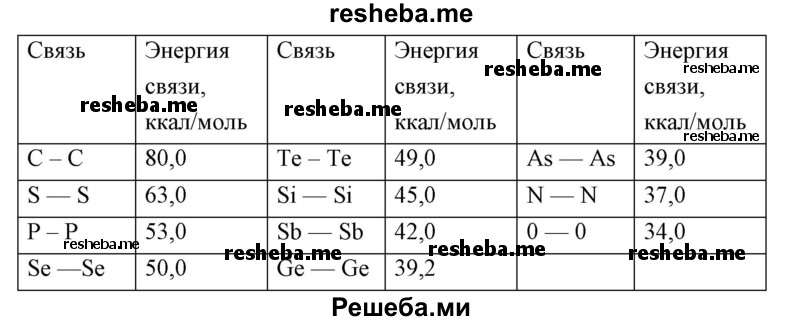
Среди всех элементов периодической системы углерод выделяется своей уникальной способностью образовывать необычайно длинные цепи полимеров.
6. Атомы бора, кремния, фосфора и др., также образуют прочные цепи из атомов этих элементов (в элементарном состоянии). Но уникальность углерода обусловлена в значительной степени тем обстоятельством, что образуемые им углерод — углеродные связи прочны и в тех случаях, когда атомы углерода одновременно связаны с другими элементами. Например, углерод — водородные и углерод — фторные соединения высоко стабильны и в химическом отношении относительно мало реакционноснособны, а соответствующие производные бора, кремния, фосфора и т. д. либо не могут быть получены, либо являются крайне реакционноснособными веществами.
7. Атомы углерода могут связываться по — разному, называясь при этом аллотропами углерода.
Вопрос 14. Основные макроэлементы, в первую очередь углерод, водород и азот, присутствуют в живых организмах в больших количествах, чем в неживой природе. Почему? Что из этого следует?
Потому что все органические соединения получены соединением этих элементов. Это связано в основном с их валентностью, равной соответственно 1, 4 и 3, а также с их способностью образовывать более прочные ковалентные связи, нежели связи, образуемые другими элементами той же валентности. Атомы углерода способны образовывать цепочки и кольца, создавая гигантское разнообразие органических молекул. Вода — вещество с уникальными свойствами, способное растворять огромное разнообразие веществ, а также стабилизировать температуру за счет высокой теплоемкости, теплоты замерзания и теплоты испарения. Азот входит в состав аминокислот. Все эти элементы входят в обменные процессы клеток и являются жизненно необходимыми химическими компонентами живых организмов.
Присутствие в живых организмах этих химических элементов в больших количествах, чем в неживой природе, наталкивает на мысль: химические соединения, содержащие углерод, водород, кислород и азот (наиболее распространенные в живой природе элементы) были отобраны из неживой природы в ходе эволюции благодаря их особой приспособленности для участия в процессах жизнедеятельности.
Вопрос 15. Какую проблему необходимо учитывать учёным в связи с разработкой и внедрением в производство новых искусственно созданных органических веществ? Обсудите это с учителем и одноклассниками.
Здесь можно выделить не одну, а несколько проблем.
1. Уменьшение количества отходов с целью уменьшения вредного воздействия на окружающую природу.
В экологическом отношении коксохимическое производство является одним из наиболее опасных. На всех его стадиях выделяется значительная масса загрязнителей. На долю коксохимического производства приходится более 70% канцерогенов от их общего количества, образующегося в металлургии (бензол, каменноугольная смола и др.).
Добыча, переработка и транспортировка нефти сопряжены с загрязнением окружающей среды (в первую очередь загрязнение Мирового океана).
2. Сохранение невозобновляемых источников сырья.
3. Увеличение эффективности переработки сырья.
Например, при переработке нефти выход наиболее ценных продуктов (бензина) недостаточен и обычно не превышает 15%, что не может покрыть все возрастающий спрос народного хозяйства на этот и другие виды моторного топлива. Увеличения их выхода достигают применением химических процессов переработки, резко увеличивающих выход бензина (до 70% массы сырья).
4. Снижение энергоёмкости производств.
5. И др.