12. Ферменты — биологические катализаторы
Подробное решение параграф § 12 по биологии для учащихся 10 класса, авторов Пасечник В.В., Каменский А.А., Рубцов А.М. Углубленный уровень 2019
Вопрос 1. Что такое катализ? Какие катализаторы химических реакций вы знаете?
Катализ — возбуждение химических реакций или изменение их скорости под влиянием веществ — катализаторов, многократно вступающих в химическое взаимодействие с участниками реакции и восстанавливающихся после каждого цикла взаимодействия свой химический состав.
Например, в некоторых химических реакциях применяются следующие катализаторы реакций Al2O3, TiO2, ThO2, MnO2, алюмосиликаты, цеолиты, CaO, BaO, MgO, Ti, Rh, Ni, квант света, повышение температуры и др.
Вопрос 2. Что такое экзо — и эндотермические реакции?
Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты в окружающую среду. Экзотермическая реакция являются, например, горение, нейтрализация, большинство реакций образования химических соединений из простых веществ.
Эндотермическая реакция — реакция, сопровождающаяся поглощением теплоты. К эндотермическим реакциям относятся диссоциация (в частности, разложение молекул на свободные атомы), восстановление металлов из руд, фотосинтез в растениях, образование некоторых соединений из простых веществ.
Вопрос 3. Что такое прямая и обратная химические реакции?
Прямая, или необратимая, химическая реакция — реакция, идущая до конца и не изменяющая своего направления при изменении температуры и давления, а также если один из продуктов реакции выводится из сферы реакции в виде газа, осадка, малодиссоциированного соединения (воды, слабой кислоты или основания, комплексной соли) или выделяется большое количество тепла (реакция горения).
Обратная, или обратимая, химическая реакция, — это такая, в результате которой полученные вещества вновь реагируют между собой с образованием исходных веществ. При одних условиях (P, t, kat) они идут в одном направлении, при других — в обратном, а при некоторых промежуточных — протекают одновременно в двух взаимно противоположных направлениях. Примером обратимых реакций служат реакции термического разложения гидроксида кальция, синтез аммиака.
Вопрос 4. Какова роль катализаторов в протекании химических реакций?
Катализаторы в протекании химических реакций могут увеличивать концентрации активных частиц в реакционной смеси, образовывать промежуточные соединения с обоими из реагентов реакции, осуществлять химическую активацию, значительно ускорять протекание химических реакций.
Вопрос 5. Что лежит в основе работы (механизма действия) любых катализаторов, в том числе ферментов?
Они снижают необходимое количество энергии активации, и за счёт этого ускоряется протекание реакции.
Вопрос 6. Какое строение имеет молекула белка — фермента?
Простые ферменты состоят только из аминокислот — например, пепсин, трипсин, лизоцим.
Сложные ферменты (холоферменты) имеют в своем составе белковую часть, состоящую из аминокислот — апофермент, и небелковую часть — кофактор (кофактор, в свою очередь, может называться коферментом (НАД+, НАДФ+, ФМН, ФАД, биотин) или простетической группой (гем, олигосахариды, ионы металлов Fe2+, Mg2+, Ca2+, Zn2+)).
Для осуществления катализа необходим полноценный комплекс апобелка и кофактора, по отдельности катализ они осуществить не могут. Кофактор входит в состав активного центра, участвует в связывании субстрата или в его превращении.
В составе белка — фермента выделяют области, выполняющие различную функцию:
1. Активный центр — комбинация аминокислотных остатков (обычно 12 — 16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ.
2. Аллостерический центр (allos — чужой) — центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов.
Вопрос 7. Какую роль в составе фермента играют коферменты? Какие вещества в организме являются их предшественниками? Приведите примеры.
Коферменты — органические природные соединения небелковой природы, необходимые для осуществления каталитического действия ферментов. Коферменты вместе с функциональными группами аминокислотных остатков фермента формируют активный центр фермента, на котором происходит связывание с субстратом и образование активированного фермент — субстратного комплекса.
Витамины, участвующие в биохимических процессах, являются предшественниками коферментов (например, витамин В1) или собственно коферментами (например, липоамид).
Вопрос 8. Как осуществляется регуляция активности фермента?
Так, активность ферментов может регулироваться при связывании низкомолекулярных соединений в специальных регуляторных центрах катализатора или же за счёт взаимодействия ферментов с активаторами или ингибиторами.
Активность многих ферментов зависит от присутствия в среде катионов и анионов. Например, активатором амилазы слюны (фермента, расщепляющего крахмал и гликоген в ротовой полости) являются анионы хлора, активаторами енолазы (фермента, катализирующего одну из реакций гликолиза) являются Mg2+, Мn2+ и К+, каталаза и пероксидаза активируются ионами Fe2+, карбоангидраза и лактатдегидрогеназа — ионами Zn2+, фосфоглюкомутаза и холинэстераза — ионами Мn2+, аскорбатоксидаза и фенолоксидаза — ионами Сu2+. Активатором многих ферментов, например, Са — кальмодулин — зависимой протеинкиназы и многих липаз, являются ионы Са2+.
В качестве активаторов или ингибиторов ферментов могут выступать и другие низкомолекулярные соединения. Так, АТФ и цитрат (лимонная кислота) ингибируют один из ключевых регуляторных ферментов гликолиза — фосфофруктокиназу, тогда как АДФ и АМФ, наоборот, активируют этот фермент.
В активации ещё одного фермента углеводного обмена — гликогенфосфорилазы, расщепляющей гликоген в клетках печени, участвуют как низкомолекулярные соединения, так и многочисленные белки.
Вопрос 9. Приведите примеры химических реакций с участием катализаторов, укажите условия их протекания.
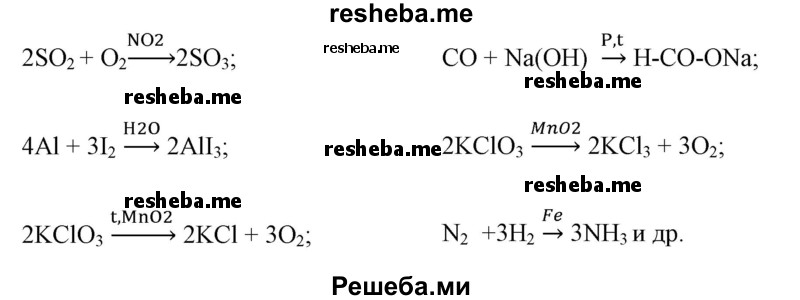
В некоторых случаях выбор катализатора влияет на путь химической реакции и, в конечном итоге, продукты реакции будут разные.
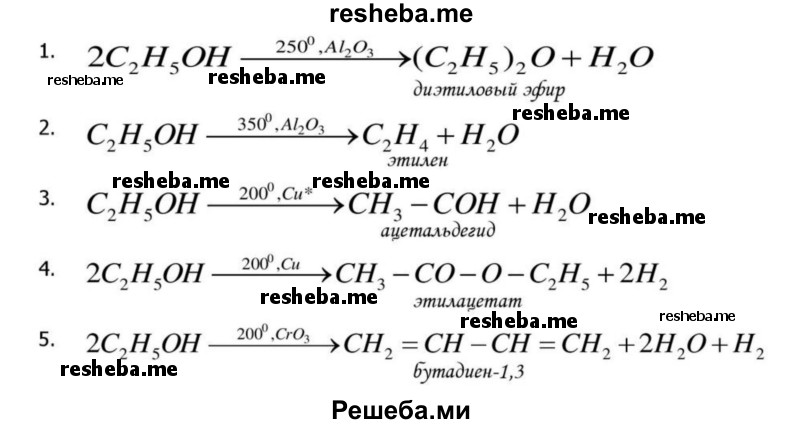
Вопрос 10. Из курса химии вам известно, что реакции, протекающие при участии катализаторов (никель, платина), требуют высоких температур и давления. Ферментативные процессы протекают в узких пределах изменения температуры и давления. Дайте объяснение этому факту.
Потому что биокатализаторы исключительно эффективны. При оптимальных условиях большинство ферментативных реакций протекает в 10 — 100 раз быстрее, чем те же реакции в отсутствие ферментов. Число оборотов (т. е. число молекул субстрата, превращаемых за одну минуту, на одну молекулу фермента) для большинства ферментов равно приблизительно 1000, а в некоторых случаях может превышать 104 . Следует при этом иметь в виду, что скорость отдельных стадий ферментативных реакций лимитируется диффузией реагирующих веществ или, во всяком случае, зависит от нее. Таким образом, многие химические реакции, которые обычно протекают только при высоких температурах или только в сильно кислой или сильно щелочной среде, в присутствии соответствующих ферментов могут идти быстро и количественно при комнатной температуре и при значениях pH, близких к нейтральному.
Вопрос 11. Почему белки редко используются организмами в качестве источника энергии для процессов жизнедеятельности?
Мономеры белков — аминокислоты — ценное сырье для построения новых белковых молекул. Поэтому полное расщепление полипептидов до неорганических веществ происходит редко. Следовательно, энергетическая функция, заключающаяся в выделении энергии при полном расщеплении, выполняется белками довольно редко.
Это невыгодно, выгоднее использовать липиды. Белки также выполняют много важных функций в организме.
Вопрос 12. Может ли один и тот же белок быть активатором одной, но при этом ингибитором другой реакции?
Может, например, протеинкиназа А одновременно способствует ингибированию синтеза гликогена и активации его распада.
Вопрос 13. Почему в качестве кофермента в активном центре присутствует низкомолекулярное вещество, а не пептидная цепь?
Сложные ферменты (холоферменты) имеют в своем составе белковую часть, состоящую из аминокислот — апофермент, и небелковую часть — кофактор (кофактор, в свою очередь, может называться коферментом (НАД+, НАДФ+, ФМН, ФАД, биотин) или простетической группой (гем, олигосахариды, ионы металлов Fe2+, Mg2+, Ca2+, Zn2+)).
Для осуществления катализа необходим полноценный комплекс апобелка и кофактора, по отдельности катализ они осуществить не могут. Кофактор входит в состав активного центра, участвует в связывании субстрата или в его превращении.
Вопрос 14. Взрослые люди часто тяжело переносят повышение температуры тела на несколько градусов от нормы, что само по себе является важнейшей защитной реакцией организма против возбудителей целого ряда заболеваний. Как это может повлиять на работу ферментов и других физиологически важных веществ организма человека, имеющих белковую природу?
Активность ферментов зависит от температуры. Та температура, при которой активность фермента наибольшая, называется температурным оптимумом (opt — t°). Для организма человека opt — t° находится в пределах 36,6 — 40°С. Снижение t° приводит к уменьшению активности ферментов, а при очень низких температурах (0° — +4°С) ферментативная активность практически прекращается, т.к. резко изменяются кинетические свойства ферментов. Поэтому снижение активности ферментов имеет обратимый характер: при повышении температуры ферментативная активность полностью восстанавливается.
Так при увеличении температуры тела с 360С до 390С скорость биохимических процессов в организме увеличивается в 1,2 — 1,4 раза. При достижении определенной t для каждого фермента, это приводит к полной инактивации фермента, которая является необратимой. При повышении t, происходит денатурация белка — фермента, разрушение активного центра фермента, образование Е — S — комплекса становится невозможным, и ферментативная реакция прекращается.
Вопрос 15. ЛАБОРАТОРНАЯ РАБОТА № 5 «Каталитическая активность ферментов (на примере амилазы)».
Цель: доказать каталитическое действие белков — ферментов, показать их высокую специфичность, а также зависимость их действия от условий среды.
Ход работы:
1. Приготовление раствора слюны, содержащего фермент амилазу.
• Тщательно прополощите рот водой.
• Наберите 2—4 мл слюны в мерный цилиндр.
• Добавьте в цилиндр воды до объёма 10 мл.
2. В две пронумерованные пробирки налейте по 10 капель раствора крахмала.
3. В пробирку № 1 внесите 4 капли воды (контроль), а в пробирку № 2 — 4 капли раствора слюны.
В пробирке №2 под действием слюны (в которой содержится амилаза) произойдет расщепление крахмала на олигосахариды (сахарозу, а она до глюкозы и фруктозы).
4. Перемешайте и поставьте на водяную баню или в термостат на 15 мин при температуре 37°С.
5. Из пробирки № 2 возьмите 4 капли исследуемого вещества и внесите их в две разные пробирки (по две капли в каждую). В одну из них добавьте каплю раствора йода в иодиде калия. В другую — каплю раствора сульфата меди (II) и 4 капли раствора гидроксида натрия и осторожно нагрейте до кипения. Те же действия проделайте с содержимым контрольной пробирки (№ 1).
6. Оформите полученные результаты в виде таблицы.
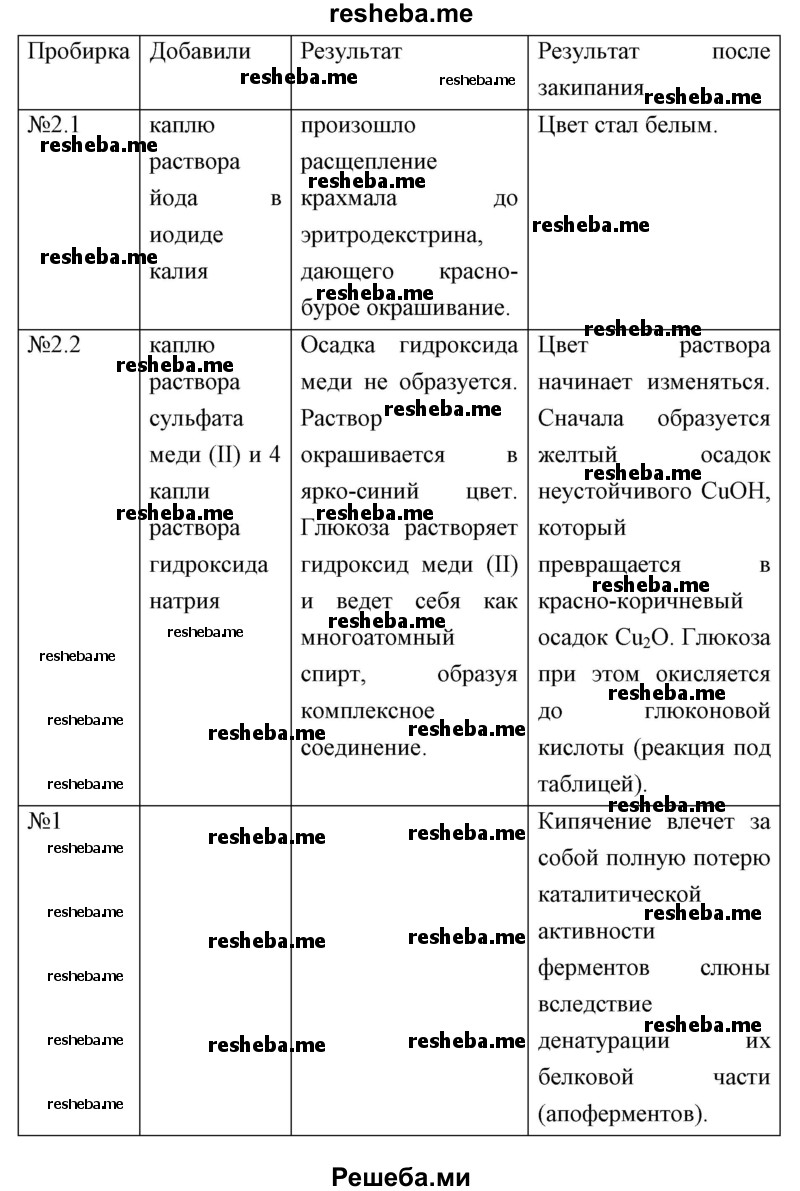
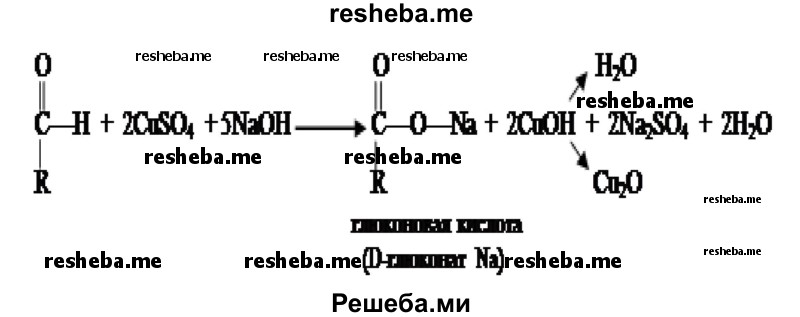
7. Сделайте вывод на основе проведённого исследования.
В качестве фермента, гидролизующего крахмал на его составные части (мальтозу, глюкозу), выступает амилаза слюны.
Каждый фермент действует только на одно вещество или группу сходных субстратов, что обусловлено соответствием структуры фермента, точнее его активного центра и структуры субстрата. Например, амилаза действует только на крахмал.
Мы также убедились в том, что фермент действует в зависимости от условий среды.